Индукция выработки нового коллагена под действием инъекций гиалуроновой кислоты после фотоповреждения кожи
Инъекции гиалуроновой кислоты интересуют специалистов не только с точки зрения немедленного эстетического эффекта, но и тем, какие изменения под их действием происходят в коже. Результаты данного исследования обосновывают эффективность использования продуктов стабилизированной гиалуроновой кислоты для стимулирования выработки коллагена в терапевтических целях, в том числе для коррекции атрофии участков кожи.
Ф. Уонг1, Л. А. Гарса1, С. Кан1, Дж. Варани2, Дж. С. Орринджер1, Г. Дж. Фишер1, Дж. Дж. Ворхес1
1 Отделение дерматологии медицинского фа‑культета Мичиганского университета, США; 2 Отделение патологии медицинского факультета Мичиганского университета, США.
Применение инъекционных дермальных филлеров растет год от года. В США инъекции филлеров на основе стабилизированной гиалуроновой кислоты — вторая по популярности малоинвазивная процедура после ботулинотерапии*. С их помощью устраняют дефекты внешнего вида кожи, обусловленные старением (морщины и складки), атрофические рубцы от акне и прочие приобретенные или врожденные изъяны.
Гиалуроновая кислота представляет собой эндогенный полисахарид, содержащийся главным образом в коже и соединительных тканях. В коже полимерные молекулы гиалуроновой кислоты могут связывать воду, образуя вязкую субстанцию, повышающую увлажнение и тургор кожи. Соответственно, потеря гиалуроновой кислоты с возрастом приводит к иссушению кожи и возникновению морщин.
Гиалуроновая кислота в коже быстро распадается, повысить ее устойчивость позволяет химическая сшивка отдельных цепей. Стабилизированная гиалуроновая кислота неживотного происхождения служит основой для самых распространенных дермальных филлеров. Считается, что она обладает длительным действием, поскольку в дополнение к стабилизирующему эффекту сшивки она абсорбирует больше воды и постепенно ее высвобождает при биодеградации. Соответственно, увлажнение помогает поддерживать объем кожи даже при распаде имплантированного материала. В клинических условиях было показано, что эффект стабилизированной гиалуроновой кислоты сохраняется от 4 до 12 месяцев. Этот показатель по крайней мере вдвое выше, чем для инъекционного коллагена, ранее считавшегося золотым стандартом дермальных филлеров.
В норме кожа состоит из внешнего эпидермиса, под которым находится поддерживающая его дерма. Дерма состоит преимущественно из секретируемых белков, совместно обеспечивающих структурную поддержку кожи. Это так называемый внеклеточный матрикс. Основной структурный белок дермы — коллаген I типа**, составляющий 90% сухого веса кожи. С возрастом количество его закономерно уменьшается. Мы обнаружили, что инъекции стабилизированной гиалуроновой кислоты стимулируют выработку нового коллагена I типа. Кроме того, нам удалось показать, что это может происходить отчасти за счет механического растяжения и последующей активации клеток дермы, вырабатывающих коллаген — фибробластов.
Методы
В рамках нашего исходного исследования в кожу предплечья с признаками фотоповреждения делали однократную инъекцию стабилизированной гиалуроновой кислоты, в результате чего возросло количество иРНК проколлагена I типа — у 4 из 6 пациентов через 1 неделю, а у 6 из 6 — через 4 недели. Основываясь на этих результатах, мы привлекли к исследованию еще несколько испытуемых (6 мужчин и 5 женщин в возрасте 64 – 84 года, средний возраст 74 года). Все 11 участников исследования имели слабопигментированную кожу; по 4‑балльной шкале клинической выраженности (отсутствует, слабое, умеренное, сильное) фотоповреждение у восьми человек оценивалось как умеренное (например, коричневые пятна, дряблость кожи, морщины и (или) неравномерная пигментация), а еще у трех — от слабого до умеренного.
Участникам исследования сделали по 3 инъекции стабилизированной гиалуроновой кислоты (объем 0,7 мл, расстояние между инъекциями 2– 5 см) в фотоповрежденную кожу наружной стороны одного из предплечий, а также по 3 инъекции в другое предплечье 0,9% стерильного раствора натрия хлорида (далее именуется «физраствор»); объем и параметры введения те же, что и для стабилизированной гиалуроновой кислоты. Места введения препаратов фотографировали. Через 4 и 13 недель после введения препаратов с каждого участка брали образец кожи диаметром 4 мм. Образцы помещали в глютаральдегид или замораживали в специальном составе для подготовки к выполнению срезов (ОСТ) при температуре –70 °С для последующего иммуногистохимического анализа. После экстракции иРНК из образцов измерили экспрессию определенных генов методом ПЦР с обратной транскриптазой в реальном времени. Результаты были нормализированы до уровня иРНК конститутивного гена 36В4.
Для статистического анализа полученных данных применялся парный t-тест со значением Р для двусторонней критической области, статистический уровень значимости Р < 0,05. Данные представлены как среднее кратное изменение ±1 СКО, где СКО — среднеквадратичное отклонение.
СТАТЬЯ ПЕЧАТАЕТСЯ С СОКРАЩЕНИЯМИ. ПОЛНЫЙ ТЕКСТ И СПИСОК ЛИТЕРАТУРЫ РАЗМЕЩЕН ЗДЕСЬ: WANG F., GARZA L. A., KANG S. ET AL. IN VIVO STIMULATION OF DE NOVO COLLAGEN PRODUCTION CAUSED BY CROSS-LINKED HYALURONIC ACID DERMAL FILLER INJECTIONS IN PHOTODAMAGED HUMAN SKIN. ARCH DERMATOL. 2007; 143:155—163. *ПО ДАННЫМ АМЕРИКАНСКОГО ОБЩЕСТВА ЭСТЕТИЧЕСКИХ ПЛАСТИЧЕСКИХ ХИРУРГОВ HTTPS://WWW.SURGERY.ORG/SITES/DEFAULT/FILES/ PDF **О РАЗНЫХ ТИПАХ КОЛЛАГЕНА И ИХ СВОЙСТВАХ ЧИТАЙТЕ СТАТЬЮ «ТИПЫ КОЛЛАГЕНА», № 2 2019.
РЕЗУЛЬТАТЫ
ПОВЫШЕНИЕ СИНТЕЗА КОЛЛАГЕНА В КОЖЕ ПОСЛЕ ИНЪЕКЦИИ
Изучение биологического действия стабилизированной гиалуроновой кислоты мы начали с окраски образцов тканей на гиалуроновую кислоту. Образцы, куда вводился физраствор, дали положительный результат окрашивания на эндогенную гиалуроновую кислоту (рис. 1 А). В коже же, получившей инъекцию стабилизированной гиалуроновой кислоты, спустя 4 и 13 недель наблюдались четко отграниченные пространства в средней и нижней части дермы. В них содержались остатки филлера, давшие положительный результат окрашивания на гиалуроновую кислоту (рис. 1 В). Это окрашивание исчезло, когда образцы прошли предварительную обработку гиалуронидазой, что подтверждает клиническую специфичность окрашивания (рис. 1 С).
Затем мы окрашивали ткань на маркеры вновь синтезированного коллагена I типа. Поскольку изначально коллаген вырабатывается в виде растворимого прекурсора (так называемого проколлагена), сначала мы применили антитело к С-концевому домену проколлагена I типа. Это антитело окрашивает внутри‑клеточные и внеклеточные эпитопы; соответственно, в образцах, обработанных стабилизированной гиалуроновой кислотой, мы обнаружили повышенное внутри- и внеклеточное окрашивание дермы по сравнению с контрольной группой (рис. 2 А). Спустя 4 и 13 недель окрашивание ограничивалось областями вокруг филлера.
Как и в случае с маркером С-концевого домена, применив антитело к N-концевому домену проколлагена I типа, спустя 4 и 13 недель мы обнаружили усиленное окрашивание на участках, где делалась инъекция стабилизированной гиалуроновой кислоты. Это антитело связывает внутриклеточный эпитоп; соответственно, мы наблюдали усиленное внутриклеточное окрашивание, особенно в клетках волокон соединительной ткани вокруг филлера (рис. 2 В). В клетках, расположенных проксимально к филлеру, также наблюдалось внутриклеточное окрашивание, но внутри пространств, где содержался филлер, окрашивания не было.
И наконец, мы выполнили окрашивание на пролил-4‑гидроксилазу — фермент, модифицирующий остатки пролина в проколлагене, что обеспечивает стабильное формирование зрелого коллагена I типа. Содержание данного фермента повышено внутри фибробластов, активно вырабатывающих проколлаген. В коже, обработанной стабилизированной гиалуроновой кислотой, спустя 4 и 13 недель окрашивание на данный маркер усилилось по сравнению с контролем, приблизившись к показателю окрашивания на антитела к N-концевому домену (рис. 2 С). Уточняя эти результаты, мы воспользовались технологией полимеразной цепной реакции с обратной транскриптазой в реальном времени, чтобы оценить уровень генной экспрессии (иРНК) для проколлагенов I и III типа. Проколлаген III типа связан с проколлагеном I типа, и содержание обоих веществ в коже регулируется во взаимосвязи. Спустя 4 и 13 недель соответственно экспрессия повысилась (среднее ± СКО) в 10,5±2,4 раза (Р=0,003) и 17,6±6,9 раза (Р=0,04) для проколлагена I типа, а также в 7,9±1,8 раза (Р=0,004) и 11,6±4,6 раза (Р=0,045) для проколлагена III типа. Image
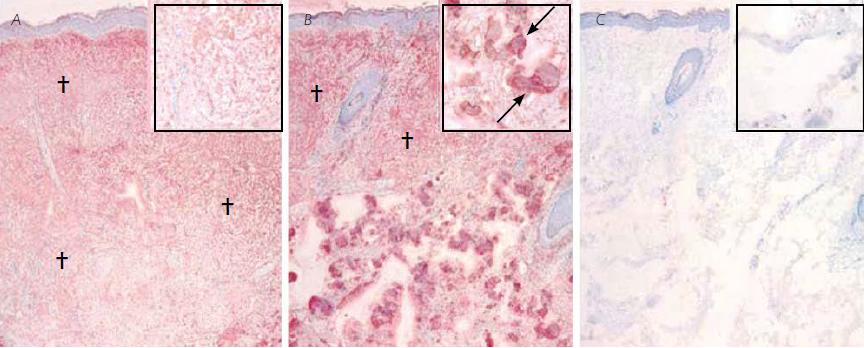
РИС. 1. Визуализация инъецированного дермального филлера на основе стабилизированной гиалуроновой кислоты в человеческой коже in vivo. В фотоповрежденную кожу предплечья ввели изотонический раствор натрия хлорида (А) илидермальный филлер на основе стабилизированной гиалуроновой кислоты неживотного происхождения (B). На рисунке показаны репрезентативные тканевые срезы спустя 4 недели после инъекции. Гиалуроновая кислота, как эндогенная, так и введенная, была обнаружена с помощью биотинилированного белка, связывающего гиалуроновую кислоту. Участки положительного окрашивания имеют красный цвет, а контрастного окрашивания гематоксилином — синий. Инъецированный филлер показан стрелками, а области кожи, содержащие эндогенную гиалуроновую кислоту, — крестиками. С - для подтверждения специфичности окрашивания серийный срез с того же образца, обработанного стабилизированной гиалуроновой кислотой, до начала окрашивания обработали гиалуронидазой. Исходное увеличение на всех основных иллюстрациях — .5, на врезках — .40.
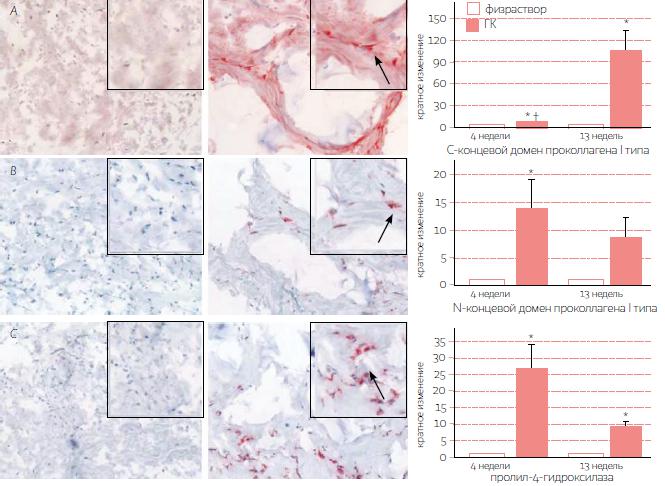
РИС. 2. Инъекции стабилизированной гиалуроновой кислоты способствуют синтезу нового коллагена в фотоповрежденной человеческой коже in vivo. После инъекции изотонического раствора натрия хлорида (слева) или стабилизированной гиалуроновой кислоты неживотного происхождения (в центре) образцы кожи окрашивали на маркеры выработки коллагена I типа, в том числе на С-концевой домен проколлагена I типа (А), N-концевой домен проколлагена I типа (В) и пролил-4‑гидроксилазу (С). На рисунке показаны репрезентативные тканевые срезы спустя 4 недели после инъекции. Участки положительного окрашивания имеют красный цвет, а контрастного окрашивания гематоксилином — синий. Некоторые фибробласты с положительным окрашиванием обозначены стрелками. Открытые участки на изображениях срезов кожи, инъецированной стабилизированной гиалуроновой кислотой, (в центре) соответствуют участкам, заполненным филлером (см. рис. 1). Исходное увеличение на всех основных рисунках — .20, на врезках — .32. Гистограммы показывают количественное соотношение окрашивания на каждый вид антител в коже, получившей инъекцию физраствора или стабилизированной гиалуроновой кислоты, спустя 4 и 13 недель (n =11). Контрольные данные нормализованы до 1. Данные по образцам, получившим инъекцию стабилизированной гиалуроновой кислоты, представлены как среднее кратное изменение ± СКО. *P < 0,05. †1,5 СКО.
ЭКСПРЕССИЯ ФАКТОРОВ РОСТА И МАТРИКСНЫХ МЕТАЛЛОПРОТЕИНАЗ
Чтобы изучить возможные механизмы, обусловливающие усиление выработки коллагена после инъекций стабилизированной гиалуроновой кислоты, мы измерили генную экспрессию факторов роста, обладающих доказанным свойством стимулировать отложение коллагена в коже. Сравнивая с контролем, мы обнаружили, что экспрессия фактора роста соединительной ткани и всех трех изоформ трансформирующего фактора роста β после инъекций стабилизированной гиалуроновой кислоты возросла (рис. 3 А).
Спустя 4 недели экспрессия каждого гена существенно возросла (Р < 0,05), а спустя 13 — значительно повысилось содержание трансформирующих факторов роста β2 и β3.
Затем мы измерили генную экспрессию матриксных металлопротеиназ. Эти ферменты играют важную роль в равновесии между выработкой и разложением коллагена. К примеру, коллагеназа 1 и коллагена за 3 расщепляют зрелый коллаген, а стромелизин 1 и желатиназа В — его фрагменты. Вместе эти четыре фермента способны расщепить все компоненты внеклеточного матрикса кожи. По сравнению с группой, где использовался физраствор, мы не обнаружили статистически значимых изменений (Р < 0,05) уровня иРНК для коллагеназы 1, коллагеназы 3 и стромелизина 1 спустя 4 и 13 недель после инъекций стабилизированной гиалуроновой кислоты. Экспрессия иРНК желатиназы В спустя 4 недели существенно не изменилась (Р=0,07), но через 13 недель продемонстрировала статистически значимое увеличение среднего значения ± СКО: в 8,9±3,3 раз (Р=0,04). Однако иммуноокрашивание не показало существенных изменений (Р=0,09) экспрессии белка желатиназы В спустя 13 недель.
Кроме того, мы изучили генную экспрессию тканевых ингибиторов матриксных металлопротеиназ — эндогенных белков, предотвращающих чрезмерное расщепление внеклеточного матрикса. В коже, получившей инъекцию стабилизированной гиалуроновой кислоты, мы наблюдали повышенную экспрессию тканевого ингибитора матриксных металлопротеиназ 1, 2 и 3 спустя 4 недели (Р < 0,05 в каждом случае) (рис. 3 В).
ПОСЛЕ ИНЪЕКЦИЙ СТАБИЛИЗИРОВАННОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ ФИБРОБЛАСТЫ ПРИОБРЕТАЮТ ХАРАКТЕРНЫЙ ДЛЯ БИОСИНТЕЗА ФЕНОТИП
С тем, чтобы лучше понять механизмы усиления выработки коллагена под действием стабилизированной гиалуроновой кислоты, мы изучили морфологические характеристики фибробластов, выявляя клетки вытянутой формы — растяжение фибробластов соответствует повышенному синтезу коллагена. Чтобы выделить дермальные фибробласты, мы провели окрашивание тканевых срезов на C-концевой домен проколлагена I типа (как показано на рис. 2 А). В коже, получившей инъекцию стабилизированной гиалуроновой кислоты, спустя 4 и 13 недель мы наблюдали множество растянутых фибробластов, погруженных в волокна соединительной ткани, окружавшие пространства, где находилась стабилизированная гиалуроновая кислота (рис. 4А). Некоторые клетки прилегали к этим пространствам непосредственно, но внутрь не попала ни одна. Во многих растянутых фибробластах был обильно представлен шероховатый эндоплазматический ретикулум, что указывало на повышенный уровень выработки белка (рис. 4 В). По сравнению с контрольной группой, эти клетки также имели большую площадь поверхности, соприкасающейся с соседними коллагеновыми волокнами.
В коже, куда вводился физраствор, дермальные фибробласты не были растянутыми и не имели заметного шероховатого эндоплазматического ретикулума.
С учетом этих наблюдений мы провели культивирование фибробластов, добавляя и не добавляя стабилизированную гиалуроновую кислоту к слою коллагена, имитирующему дермальный внеклеточный матрикс. В присутствии одного лишь коллагена фибробласты распределились равномерно. В культурах, где присутствовала стабилизированная гиалуроновая кислота, филлерный материал распределился в виде разрозненных участков (как наблюдалось in vivo), а фибробласты скапливались вокруг филлера. Внутри филлера клеток не наблюдалось, что позволяет предположить, что фибробласты не склонны заполнять собою филлер или связывать его. Image
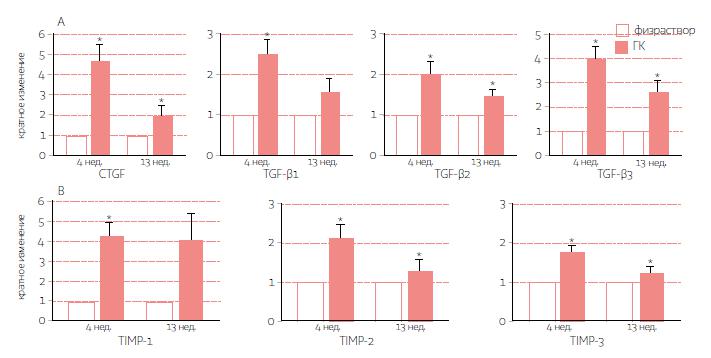
РИС. 3. Инъекции стабилизированной гиалуроновой кислоты усиливают генную экспрессию профибротических факторов роста и тканевых ингибиторов матриксных металлопротеиназ в человеческой коже in vivo. Общее количество иРНК из кожи, получившей ту или иную инъекцию, а также транскрипты указанных генов были измерены методом полимеразной цепной реакции с использованием обратной транскриптазы в реальном времени. А. Экспрессия профибротических факторов роста, в том числе фактора роста соединительной ткани (CTGF) и трех изоформ трансформирующего фактора роста β (TGF-β1, TGF-β2 и TGF-β3). В. Экспрессия трех тканевых ингибиторов матриксных металлопротеиназ (TIMP-1, TIMP-2 и TIMP-3). Представлены данные спустя 4 и 13 недель. Данные для контрольной группы (кожа с инъекцией изотонического раствора натрия хлорида) нормализованы до 1, данные для кожи с инъекцией стабилизированной гиалуроновой кислоты представлены как среднее кратное изменение ± СКО. *P < 0,05.
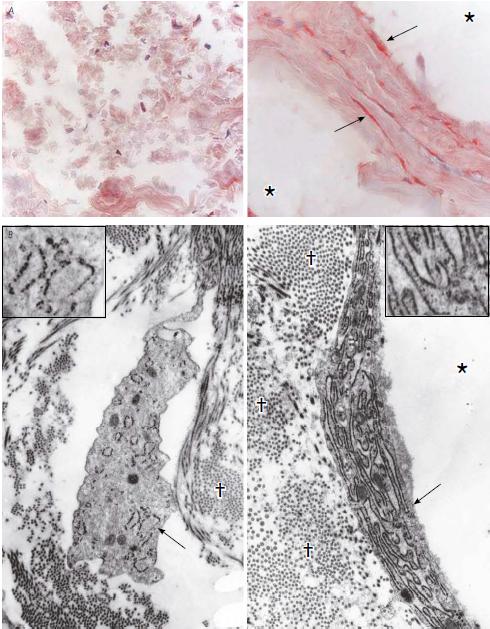
РИС. 4. Фибробласты кожи, получившей инъекцию стабилизированной гиалуроновой кислоты, имеют растянутую форму и синтетически активный фенотип. Показаны фибробласты кожи, в которую вводился изотонический раствор натрия хлорида (слева) и стабилизированная гиалуроновая кислота (справа). На иллюстрации показаны репрезентативные тканевые срезы спустя 4 недели после инъекции. Открытые пространства (обозначены звездочками) на рисунках, относящихся к инъекциям стабилизированной гиалуроновой кислоты, соответствуют областям, содержащим филлер. А. Тканевые срезы окрашивали на С-концевой домен проколлагена I типа (как ранее показано на рис. 2 А). Фибробласты с положительным окрашиванием (показаны стрелками) имеют темно-красный цвет. Ядра клеток контрастно окрашены гематоксилином (синий цвет) (исходное увеличение — .40). В. Фибробласты исследованы методом трансмиссионной электронной микроскопии. Крестиками отмечены коллагеновые волокна/фибриллы во внеклеточном матриксе. Стрелками показан шероховатый эндоплазматический ретикулум — внутриклеточная структура, участвующая в синтезе белков, в том числе коллагена. Эти структуры показаны под большим увеличением на врезках (исходное увеличение на основных рисунках — .2200, на врезках — .5300).
ОБСУЖДЕНИЕ
Принято считать, что многие дермальные филлеры улучшают внешний вид кожи за счет того, что физически занимают определенный объем. В самом деле, нам удалось наблюдать присутствие в коже введенной стабилизированной гиалуроновой кислоты — это означает, что ее эффект обусловлен в том числе заполнением пространства. Чтобы всесторонне изучить возможные механизмыдлительного косметического эффекта этого филлера, мы оценили биологическую реакцию кожи на стабилизированную гиалуроновую кислоту. Нам удалось обнаружить, что ее инъекции усиливают выработку коллагена I типа в фотоповрежденной коже предплечья. В настоящее время нет данных, заставляющих полагать, что кожа с разных анатомических участков дает разную биологическую реакцию. Соответственно, вероятно, что повышение выработки коллагена I типа увеличивает длительность клинического эффекта стабилизированной гиалуроновой кислоты и в коже лица; именно в эту область чаще всего вводят филлеры.
Мы наблюдали усиление внутриклеточного и внеклеточного иммуноокрашивания на синтез проколлагена I типа в коже, получившей инъекцию стабилизированной гиалуроновой кислоты. Это согласуется с характером выработки коллагена I типа — белка, синтезируемого внутри клеток и выделяемого в окружающий внеклеточный матрикс. По форме и локализации положительно окрашенные клетки соответствовали фибробластам — главной «фабрике» коллагена в коже. Также мы показали, что генная и белковая экспрессия проколлагена остается повышенной в течение по крайней мере 13 недель, что подразумевает, что стабилизированная гиалуроновая кислота активирует синтез коллагена в коже на длительное время.
Мы предположили, что стимуляция фибробластов может происходить в результате опосредованного рецепторами взаимодействия с инъецированной стабилизированной гиалуроновой кислотой.
Фибробласты могут связывать эндогенную гиалуроновую кислоту с помощью разных рецепторов, в том числе CD44 — рецептора опосредованной гиалуронаном подвижности, фактора межклеточной адгезии и др. На связывание гиалуроновой кислоты указывает активация, миграция клеток, воспалительная активность и другие процессы. Как in vivo, так и in vitro мы наблюдали, что фибробласты склонны прикрепляться не к стабилизированной гиалуроновой кислоте, а к коллагеновому матриксу. Хотя эти наблюдения не исключают непосредственного стимулирующего эффекта инъецированной стабилизированной гиалуроновой кислоты, они позволяют предположить, что прикрепление клеток к стабилизированной гиалуроновой кислоте незначительно и не играет большой роли в стимуляции выработки коллагена.
Однако, согласно нашим результатам, для стимуляции синтеза коллагена принципиально важно механическое натяжение. Во внеклеточном матриксе, окружающем области стабилизированной гиалуроновой кислоты, мы обнаружили механически растянутые фибробласты. In vivo такие растянутые клетки располагались вблизи филлера, но не всегда непосредственно в контакте с материалом (см. рис. 2 и 4).
В совокупности с нашими наблюдениями in vitro, это дает основания полагать, что инъекции стабилизированной гиалуроновой кислоты увеличивают выработку клетками коллагена за счет растяжения имеющихся коллагеновых волокон. Растяжение же, в свою очередь, может вызывать механическое натяжение соседних фибробластов, взаимодействующих с коллагеновыми волокнами посредством рецепторов интегринов на поверхности клетки. Неоднократно доказано, что механическое натяжение внеклеточного матрикса способствует морфологическому растяжению фибробластов и инициирует синтез коллагена. В отличие от клеток, не испытывающих натяжения, фибробласты, культивируемые в механически напряженных коллагеновых каркасах, принимают растянутую, веретенообразную форму вместо короткой и округлой. Эти фибробласты реорганизуют свой актиновый цитоскелет, чтобы адаптироваться к условиям натяжения.
Кроме того, растянутые фибробласты увеличивают выработку компонентов соединительной ткани, таких как коллаген I и III типов. Предполагается, что это следствие динамической реакции клеток, направленной на противодействие стороннему натяжению.
Аналогичным образом поддерживается механическое натяжение молодой кожи: интактные коллагеновые волокна обеспечивают устойчивый каркас, к которому могут прикрепляться фибробласты. Что же касается фотоповрежденной зрелой кожи, в ней со‑ держится большее количество расщепленного коллагена. Такое расщепление ослабляет структурную целостность внеклеточного матрикса, из‑за чего механическое натяжение фибробластов уменьшается, отсюда и появление «сдутых» (сферических) фибробластов, и снижение выработки коллагена. Поскольку стабилизированная гиалуроновая кислота локализуется в определенных областях фотоповрежденной кожи, мы полагаем, что это вещество склонно проникать в области расположения фрагментированных волокон, поскольку эти зоны более рыхлые. Введенная гиалуроновая кислота, вероятно, «напирает» на имеющиеся волокна, тем самым создавая более жесткий каркас, подобный присутствующему в молодой коже. За счет этого усиливается механическое натяжение, стимулирующее фибробласты вырабатывать новый интактный коллаген (рис. 5).
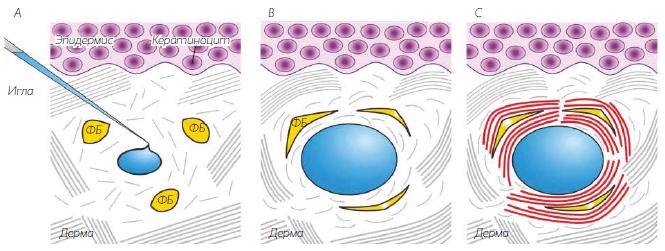
РИС. 5. Рабочая модель механического натяжения (растяжения) как механизма выработки коллагена в коже человека под действием инъекций стабилизированной гиалуроновой кислоты. В отличие от молодой кожи, содержащей интактные коллагеновые волокна, фотоповрежденная зрелая кожа (показанная на рисунке) имеет также области фрагментированных волокон коллагена. А. Показано, что стабилизированная гиалуроновая кислота преимущественно локализуется в областях, отличающихся большей фрагментированностью волокон коллагена, поскольку эти зоны более проницаемы. В. Это приводит к растяжению имеющихся коллагеновых волокон (показаны изогнутыми линиями), что передается соседним фибробластам (ФБ) посредством рецепторов клеточной поверхности, например, интегринов. В ответ фибробласты приобретают растянутую форму (В) и активируются для выработки компонентов внеклеточного матрикса (С), в том числе новых, интактных волокон коллагена (показаны красными линиями).
Кроме того, мы обнаружили, что инъекции стабилизированной гиалуроновой кислоты могут способствовать синтезу коллагена за счет повышения количества фактора роста соединительной ткани и трансформирующего фактора роста β. Эти профибротические факторы роста стимулируют выработку коллагена фибробластами и играют ключевую роль в формировании соединительной ткани при заживлении ран. Хотя такое усиление относительно невелико, малые количества факторов роста зачастую обеспечивают биологически значимый эффект. Таким образом, выработка факторов роста, по всей вероятности, способствует синтезу нового внеклеточного матрикса в коже, получившей инъекцию стабилизированной гиалуроновой кислоты. При сниженном содержании коллагена усиливается формирование морщин, поэтому стимуляция выработки коллагена под действием стабилизированной гиалуроновой кислоты может отчасти объяснять косметический эффект этого филлера.
Инъекции стабилизированной гиалуроновой кислоты способствуют усиленной выработке коллагена за счет механического натяжения фибробластов, увеличения содержания факторов роста и ингибирования расщепления коллагена.
Самым важным из факторов, обусловливающих выработку коллагена, вероятно, является механическое натяжение, поскольку, как было показано, оно стимулирует выработку фибробластами факторов роста и тканевых ингибиторов матриксных металлопротеиназ, а также ингибирование экспрессии матриксных металлопротеиназ. Таким образом, механическое натяжение может быть непосредственным стимулом, обусловливающим многие из наблюдаемых нами явлений. Наши результаты позволяют также предположить, что стабилизированная гиалуроновая кислота может успешно применяться как стимулятор выработки коллагена в условиях нехватки последнего, в том числе при атрофических нарушениях (например, при ВИЧ-обусловленной липодистрофии или дермальной атрофии под действием стероидов).
Кроме того, гистологические исследования показывают, что инъецированная стабилизированная гиалуроновая кислота сохраняется в коже в течение 6 – 9 месяцев. Это хорошо согласуется с данными о клинической длительности действия стабилизированной гиалуроновой кислоты и позволяет предположить, что эффект в течение этого времени сохраняется преимущественно за счет объема. Однако, как мы предполагаем, по мере постепенного добавления инъекций стабилизированной гиалуроновой кислоты в определенную область там будет накапливаться и коллаген. Это связано с тем, что период полуразложения коллагена кожи оценивается примерно в 15 лет. Соответственно, мы можем предположить, что накопление коллагена в результате многократных инъекций стабилизированной гиалуроновой кислоты может со временем дать тельный косметический эффект.
Стимуляция неоколлагенеза: критерии выбора
Почему сегодня процедуры, стимулирующие синтез коллагена в коже, становятся все более актуальными? Ответ на этот вопрос — в глобальных процессах, связанных с ростом числа людей старшего возраста в развитых странах и увеличением средней продолжительности жизни. При этом люди среднего и старшего возрастов хотят быть социально активными, чувствовать себя здоровыми и выглядеть молодыми. Если у 40‑летних пациентов для достижения эффекта молодости нас удовлетворяют биоревитализирующие процедуры, то у 50‑летних первоочередной задачей косметолога становится стимуляция синтеза коллагена и поддержание качества его структурных волокон.
Н. С. Исмаилова, к. м. н., врач-дерматовенеролог, косметолог, генеральный директор и научный руководитель компании «МЕЛИС», член Американской академии эстетической медицины, г. Москва
Кожу человека можно рассматривать как крупнейший в организме эндокринный орган: она не только является мишенью, но и непосредственно участвует в синтезе и трансформации гормонов. Рецепторы к эстрогенам присутствуют в клетках и органах кожи, напрямую связанных с процессами репарации: в кератиноцитах, фибробластах, волосяных фолликулах. И именно кожа лица становится основной мишенью для дегенеративных возраст-ассоциированных изменений [2]. Коллаген — основной структурный белок межклеточного матрикса, представляющий собой 70% массы белка кожи и определяющий ее механические свойства (упругость/эластичность). В фибробластах проходит синтез тропоколлагена с последующим поступлением его в матрикс и сборкой спирали коллагенового волокна путем образования дисульфидных связей. В разных тканях и органах преобладают различные типы коллагена (всего 19 типов). В коже — это прочные фибриллярные коллагены I и III типа. Коллаген III типа характерен для сосочкового слоя дермы и представлен волокнами небольшого диаметра, собранными в мелкие пучки. Коллаген I типа пре‑ обладает в сетчатом слое, для него характерны более крупные волокна, образующие характерную структуру, давшую название слою и отвечающую за прочность кожи.
В первые пять лет после наступления менопаузы кожа теряет до 30% коллагена, далее его содержание снижается на 2% в год.
С возрастом изменяется общий уровень содержания коллагена в дерме, а также уменьшается процентное соотношение между III («молодым») / I («зрелым») типами коллагена. Данные изменения определяются не хронологическим возрастом, а гормональным статусом женщины [3]. Это, в свою очередь, приводит к прогрессирующей сухости, потере эластичности кожи, увеличению глубины, длины и площади морщин, снижению регенерационного потенциала, ухудшению микроциркуляции и кровоснабжения кожи. Таким образом, вопрос стимуляции синтеза коллагена и поддержания качества его структурных волокон выходит на первый план. Современная эстетическая медицина предлагает широкий спектр методик для поддержания выработки нативного коллагена. Из них мы можем выделить инъекционные методы, которые обладают наиболее таргетным и сильным воздействием, что позволяет добиваться быстрого и выраженного результата. А именно, введение в дерму полимолочной кислоты, гидроксиапатита кальция и натурального коллагена (КОЛЛОСТ, «НИАРМЕДИК», Россия). Имплантат для подкожного введения, представляющий собой гидрогель поли-L-молочной кислоты (PLLA), оформлен в микросферы диаметром 40 – 6 микрон. Это оптимальный размер, обеспечивающий проходимость препарата через тонкие иглы и в то же время превышающий 30 мкм во избежание интракапиллярной диффузии. Полимолочная кислота является биосовместимым, биодеградируемым синтетическим средством и способна восполнять дефицит объема тканей за счет стимуляции неоколлагенеза. Микросферы PLLA образуют скаффолд для образования новой ткани. Формирование капсулы в ходе каскада реакций, характерных для воспалительного ответа на инородное тело, приводит в течение месяца к перерождению грануляционной ткани в соединительную и образованию коллагеновых фибрилл с последующим созреванием коллагена [4]. Мелкодисперсные частицы абсорбируются тканями организма, в то время как стимулирующий эффект препарата сохраняется до 12 месяцев. Метаболизация полимолочной кислоты происходит поэтапно: с распадом на мономеры молочной кислоты и в дальнейшем с трансформацией в глюкозу и углекислый газ.
ДЕРМАЛЬНЫЙ ФИЛЛЕР СИНТЕТИЧЕСКОГО ГИДРОКСИАПАТИТА КАЛЬЦИЯ (CAHA)
Препарат представляет собой микросферы диаметром 25-45 мкм, взвешенные в водном геле-носителе. Он выступает как в качестве дермального филлера так и для механического заполнения депрессий кожи, так и в качестве стимулятора синтеза собственного коллагена для повышения плотности и качества кожи. Первичная волюмизация происходит за счет геля-носителя на основе карбоксиметилцеллюлозы. На последующих этапах микросферы CaHA выступают в роли каркаса, вокруг которого формируется новая соединительная ткань путем механической стимуляции фибробластов к синтезу коллагена и эластина, чем и объясняется пролонгированный эффект препарата до 1,5 – 2 лет. CaHA — неорганический материал, биосовместимый, биодеградирующий до ионов кальция и фосфора посредством гидролиза в течение года после имплантации. Коллагеновый комплекс КОЛЛОСТ («НИАРМЕДИК», Россия) содержит коллаген I типа, полученный из кожи крупного рогатого скота. Уникальной особенностью препарата является полностью сохраненная сетчатая структура макромолекул нативного материала, которая после инъецирования выступает как матрица для образования новой ткани.
Введение препарата КОЛЛОСТ не стимулирует формирование фиброзной соединительнотканной капсулы, а способствует наиболее органичной интеграции новой ткани в дерму.
В структуру решетки импланта мигрируют фибробласты, синтезирующие новый коллаген на ее ячейках, что позволяет естественным образом заменить собственной соединительной тканью рассасывающийся имплантат. Новая ткань гистологически сходна с окружающими тканями. Метаболизм коллагена является медленным процессом. Его многоступенчатый синтез растянут во времени и положительный эффект отмечается спустя три-четыре недели. Эффект постепенно нарастает и достигает своего максимума через 6 месяцев спустя. Период полувыведения коллагена также составляет месяцы. Волокна имплантата резорбируются макрофагами с помощью ферментов коллагеназы. Процесс сопровождается пролиферацией эпителиальных клеток, активацией факторов роста, неоангиогенезом.
РИСК РАЗВИТИЯ ОСЛОЖНЕНИЙ
Животный (бычий или свиной) коллаген являетсядля организма чужеродным белком, соответственно, возможен риск возникновения аллергии. Такие нежелательные явления обычно носят временный характер и исчезают с резорбцией имплантата [5]. Эти данные основаны на имеющемся мировом опыте использования различных продуктов на основе животного коллагена. Что касается непосредственно препарата КОЛЛОСТ, то за многие годы его использования на территории России и Европы были отмечены лишь незначительные единичные случаи аллергической реакции. Наличие аллергопробы в комплекте с основным препаратом снижает эти риски до минимума. При введении полимолочной кислоты возможно развитие подкожных фиброзных узелков и классических гигантоклеточных гранулем. Среди причин образования: гиперкоррекция, неверное разведение препарата перед введением, чрезмерно поверхностное введение и, в первую очередь, неверный выбор области коррекции. Возникновение фиброзных узелков особенно характерно в случае инъекций в периорбитальную область и в область губ [6]. Препараты на основе гидроксиапатита кальция противопоказаны к введению в губы, так как в этой зоне он имеет тенденцию к комкованию и образованию узелков. У возрастных пациентов наблюдались гранулемы из плотных микросфер и гигантских клеток [7]. Они могут возникать как спустя непродолжительное (несколько недель) время, так и в качестве отдаленных последствий спустя годы после инъекции. У большинства пациентов с осложнениями после введения PLLA и CaHA постоянные узелки отмечались через 6 – 8 месяцев (диапазон от 2 до 36 месяцев) после инъекции [8]. Средний срок развития осложнения — 6 месяцев. Гранулемы на основе CaHA имеют нечеткие очертания, в то время как гранулемы PLLA имеют явные контуры. Но в целом гистологические образования после введения PLLA и CaHA сходны между собой и отличаются от силиконовых гранулем. Они представляют собой характерные скопления эпителиоидных гистиоцитов с инородным материалом.
ОСОБЕННОСТИ И ОГРАНИЧЕНИЯ ПРИМЕНИМОСТИ ПРЕПАРАТОВ
Как стимулятор коллагена препарат гидроксиапатита кальция вводится субдермально в разведении физиологическим раствором в технике «мезорадиес» как иглой, так и канюлей [9]. Для поверхностного введения препарат неприменим. Для стимуляции неоколлагеногенеза гидрогель поли-L-молочной кислоты также вводится субдермально иглой/канюлей. Его особенностью является необходимость в разведении гранул препарата физиологическим раствором за 24 часа до процедуры, что усложняет работу косметолога.
ЗОНЫ ПРИМЕНЕНИЯ
РИС. 1. Субдермальное введение препарата гидроксиапатита кальция в векторной технике, канюля 25Gх50 мм.
Препараты гидроксиапатита кальция и поли-L-молочной кислоты являются не только стимуляторами синтеза коллагена, но, в первую очередь, применяются для объемного моделирования средней трети и коррекции овала лица, а также для нехирургической ринопластики. Процедуры с этими препаратами проводятся не чаще, чем 1 раз в 2 – 3 месяца. Иногда достаточно двух процедур 1 раз в 6 месяцев для достижения нужного результата. Техника их введения требует высокой квалификации (рис. 1).
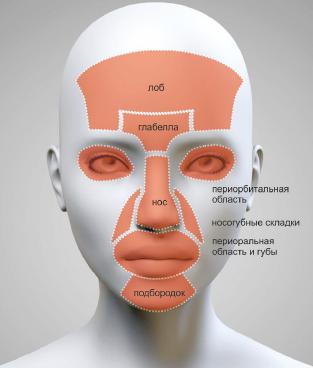
РИС. 2. Зоны риска при введении препаратов гидроксиапатита кальция и поли-L-молочной кислоты.
Оба препарата необходимо с крайней осторожностью применять в области носа и носогубных складок, лба, глабеллы и других деликатных зон (рис. 2). В области шеи эти препараты используются для устранения дряблости и уплотнения кожи, при этом не исключены риски возникновения таких нежелательных явлений, как контурирование (препараты поли-L-молочной кислоты) или видимое просвечивание (препараты гидроксиапатита кальция), так как основное вещество в его составе имеет белый цвет. Данные проблемы врачи предупреждают, используя больший объем растворителя.
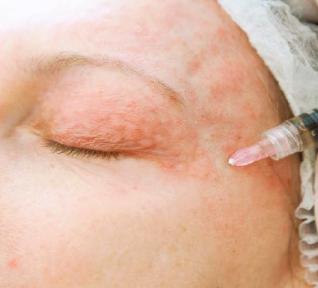
РИС. 3. Введение препарата КОЛЛОСТ в периорбитальной зоне.
Препараты гидроксиапатита кальция и поли-L-молочной кислоты запрещены к применению в периорбитальной и периоральной зонах, коррекция которых имеет огромное значение для эстетического омоложения лица. Препарат на основе коллагена КОЛЛОСТ рекомендован для омоложения лица, в том числе для коррекции кисетных морщин и «гусиных лапок» (рис. 3).
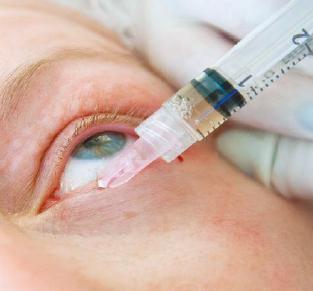
РИС. 4. Введение препарата КОЛЛОСТ.
КОЛЛОСТ-гель представляет собой вязкую взвесь, что в определенной степени затрудняет его введение при комнатной температуре. Поэтому перед процедурой необходимо разогреть препарат до 36 – 40 °С, после этого он становится пригодным для введения с помощью тонких игл диаметром 32-33G. Уникальным преимуществом КОЛЛОСТа является возможность работы в области подвижной части века. В этой зоне препарат вводится мелкопапульной техникой максимально близко к ресничному краю, обрабатывается вся поверхность века (рис. 4).
При введении препарата КОЛЛОСТ нет риска гиперкоррекции, так как препарат пластично распределяется в тканях. Схема применения — 1 раз в 2 недели. Уже после 3 – 4 процедуры виден отчетливый результат, отмечается высокая удовлетворенность пациентов. КОЛЛОСТ не вызывает отсроченных осложнений в виде узелков и гранулем. После инъекций препарата происходит преобразование фибробластами введенной коллагеновой матрицы в собственные коллагеновые волокна. Коллагенотерапия не вступает в конфликт с другими методиками и не имеет ограничений по возможностям применения. Стимуляция синтеза нового коллагена позволяет добиться видимого улучшения качества кожи даже у пациентов старшей возрастной группы. Препарат эффективен для борьбы с атрофическими рубцами, шрамами, растяжками, после процедуры не требуется длительной реабилитации. Таким образом, в зависимости от индивидуальных потребностей пациента, от того, какие проблемные зоны нуждаются в коррекции и от выраженности симптоматики, врач-косметолог может выбрать оптимальный препарат для коллагенотерапии.
ЛИТЕРАТУРА
- Life expectancy and Healthy life expectancy. Data by country. World Health Organization, 2016.
- Emmerson, E., and Hardman, M. J. The role of estrogen deficiency in skin ageing and wound healing. Biogerontology. 2012 Feb; 13 (1): 3 – 20.
- Affinito P., Palomba S., Sorrentino C. et al. Effects of postmenopausal hypoestrogenism on skin collagen. Maturitas. 1999; 33: 239 – 247.
- Morphological transformation of implant from polylactic acid and its subdermal localization.G. M. Mogilina, E. V. Fomicheva, E. Y. Blatt. Cuban State Medical University. Journal of new medical technologies. 2018. Vol. 25. p. 182 – 186.
- Haneke E. Managing Complications of Fillers: Rare and Not-So-Rare. J Cutan Aesthet Surg. 2015 Oct-Dec; 8 (4):198 – 210.
- Apikian M, Roberts S, Goodman GJ. Adverse reactions to polylactic acid injection in the periorbital area. J Cosmet Dermatol. 2007; 6:95 – 101.
- Sidwell RU, Dhillon AP, Butler PE, Rustin MH. Localized granulomatous reaction to a semi-permanent hyaluronic acid and acrylic hydrogel cosmetic filler. Clin Exp Dermatol. 2004; 29:630 – 2.
- N. J. Lowe, C. A. Maxwell, R. Patnaik. Adverse reactions to dermal fillers: review. Dermatol Surg, 31 (2005), pp. 1616 – 1625.
- Юцковская Я. А., Сергеева А. Д., Стимуляция синтетической активности фибробластов. СовершенствоProfi, 2017, стр. 30 – 31.



 Сайт может содержать материалы, предназначенные для лиц старше 18 лет
Сайт может содержать материалы, предназначенные для лиц старше 18 лет
