Внеклеточный матрикс состоит из двух основных классов макромолекул: протеогликанов и волокнообразующих белков. К последним относят коллагены, эластин, фибронектин и ламинины [1]. Коллагены* наиболее распространены в тканях организма и отвечают за их прочность, но там, где требуется гибкость и растяжимость, на первый план выходит эластин.
Н. П. Михайлова, к. м. н., врач-дерматовенеролог, косметолог, доцент кафедры кожных болезней и косметологии ФДПО РНИМУ им. Н. И. Пирогова, научный руководитель Международной академии эстетической медицины Натальи Михайловой, руководитель образовательного проекта ENTERESTET, г. Москва
Н. Б. Свищева, инженер‑исследователь Института синтетических полимерных материалов им. Н. С. Ениколопова РАН, г. Москва, лаборант лаборатории химического и биотехнологического синтеза Московского физикотехнического института, г. Долгопрудный
Эластин — нерастворимый полимер тропоэластина, кроме структурной функции участвующий в передвижении и адгезии клетки и обладающий сигнальной способностью. Физиологическая функция многих тканей в многоклеточных организмах требует, чтобы они обладали эластичностью. Так, вдох — это активный, требующий энергии процесс, а выдох — пассивный из‑за упругой отдачи, обеспечиваемой эластином. Эластичность достигается у живых организмов с помощью различных неродственных белков: резилина у членистоногих, абдуктина у моллюсков и эластина у позвоночных. Филогенетические исследования показали, что эластин встречается у всех видов позвоночных: в тканях он находится во внеклеточном матриксе и занимает до 57% аорты, 50% связок, 32% крупных сосудистых сосудов, 7% легких и 5% кожи по сухой массе [2].
С помощью электронного микроскопа видно, что эластические волокна состоят из двух морфологически различимых компонентов:
- Аморфная фракция (не имеющая какой‑либо видимой регулярной или повторяющейся структуры). Составляет 90% зрелого волокна и содержит исключительно эластин.
- Компонент, состоящий из фибрилл размером от 10 до 12 нм, расположенных преимущественно по периферии аморфного компонента, но также в некоторой степени вкрапленных в него (рис. 1). Это, в основном, гликопротеин фибриллин, но также и фибулины, коллаген VIII, эмилины с микрофибриллами.
*О роли этих гликопротеинов в организме человека читайте статью Н. П. Михайловой и Н. Б. Свищевой «Типы коллагена» в №2-2019.
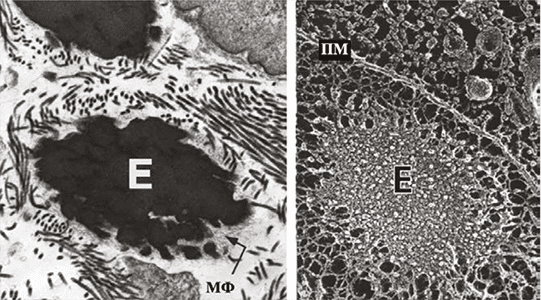
РИС. 1. Электронные микрофотографии волокон эластина [3]. Слева: просвечивающая микроскопия развивающегося легкого, показывающая эластическое волокно, состоящее из эластина (E) и микрофибрилл (МФ). Справа: аналогичное эластичное волокно визуализируется с помощью метода «замораживаниятравления». Плазматическая мембрана соседней клетки проходит сверху справа и обозначается ПМ.
Аминокислотный анализ эластина широкого спек‑ тра видов позвоночных выявил своеобразный со‑ став, придающий белку уникальные физические свойства. Он богат глицином (33%) и пролином (10–13%), а гидрофобные аминокислоты составля‑ ют примерно 44% от общего количества остатков. Высокое содержание гидрофобных аминокислот делает эластин одним из самых химически стой‑ ких и прочных белков во всем организме. Череду‑ ющиеся с этими доменами гидрофильные области характеризуются высоким содержанием лизина и аланина и их вовлечением в сшивку. Хотя эла‑ стин содержит около 4% лизина, большинство ли‑ зинов включены в поперечные связи, и в эластино‑ вой части зрелого волокна очень мало заряженных остатков (рис. 2). В настоящее время считается, что многочисленные пролин-глициновые домены, рас‑ сеянные по всей молекуле, играют ключевую роль в гибкости эластина [4]. Эта уникальная аминокис‑ лотная пара сочетает в себе способность пролина нарушать вторичное структурное образование с конформационной пластичностью глицина. Поэ‑ тому эластин примерно в 1000 раз более гибкий, чем коллагены [5]. Другие отличия эластина — очень малое количество остатков гидроксипроли‑ на, отсутствие гидроксилизина, значительная доля гидрофобных аминокислот в составе. Отсюда вы‑ текает невозможность создания стабильной гло‑ булы, следовательно, нет и регулярной вторичной, третичной структур.
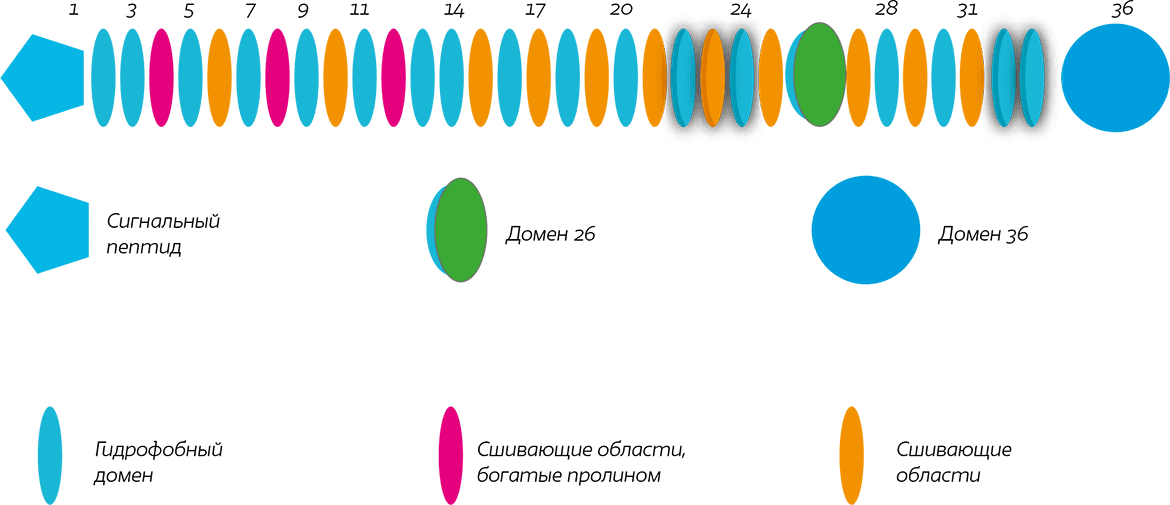
РИС. 2. Схема доменов тропоэластина человека, содержащая все возможные экзоны. Выделены экзоны, подлежащие альтернативному сплайсингу. Домены 34, 35 отсутствуют в геномных последовательностях.
Эластин образуется после сборки и сшивания его растворимого предшественника, тропоэластина [6]. Тропоэластин, как и его полимер эластин, яв‑ ляется сигнальной молекулой. Тропоэластин ин‑ гибирует пролиферацию гладкомышечных клеток артерий, индуцирует образование и организацию актиновых стресс-волокон и действует как хе‑ мотаксический агент. На аминокислотном уров‑ не тропоэластин имеет более чем 70% сходство для всего спектра позвоночных млекопитающих. Тропоэластин секретируется из эластогенных ти‑ пов клеток, прежде всего фибробластами, эндоте‑ лиальными и гладкомышечными клетками, хондро‑ цитами и кератиноцитами. В отличие от коллагена, который включает в себя семейство генов, у чело‑ века есть только один ген тропоэластина [7]. Пред‑ шественник эластина секретируется в виде негли‑ козилированного белка ~60 КДА [8]. Первичный транскрипт эластина подвергается обширному альтернативному сплайсингу кассетным способом, образуются различные изоформы тропоэластина. Они отличаются по первичной структуре наличи‑ ем или отсутствием отдельных доменов. Сплайсинг первичного транскрипта тропоэластина являет‑ ся тканеспецифичным и позволяет осуществлять конформационную и функциональную настройку для каждой конкретной ткани, будь это стенка аор‑ ты или кожа [9]. Тропоэластин самостоятельно со‑ бирается в глобулы диаметром несколько микрон, которые остаются привязанными к поверхности клетки (рис. 3). Он подвергается быстрой упорядо‑ ченной сборке и сшиванию в эластин после экскре‑ ции во внеклеточное пространство. Белки тропо‑ эластина связываются друг с другом посредством ковалентного сшивания, катализируемого лизи‑ локсидазой, медь (Cu2+)-зависимым ферментом. Реакции сшивки быстро ковалентно соединяют растворимые цепи тропоэластина в нераствори‑ мый полимерный белок эластин, который не может быть диссоциирован на компонентные субъедини‑ цы.
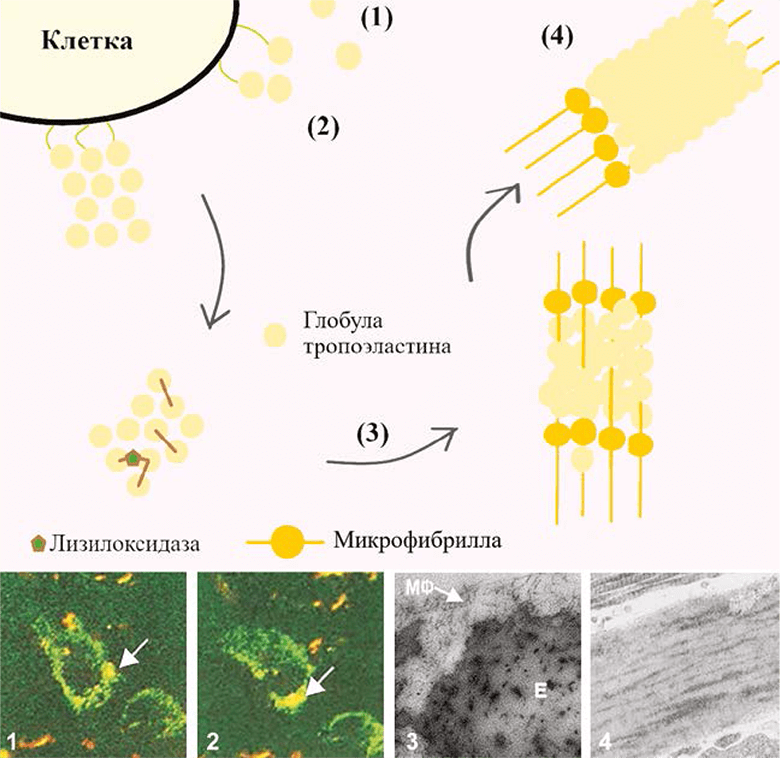
РИС. 3. Схематическое представление эластогенеза [4]: (1-2) секретируемый тропоэластин коацервируется в сферы и привязывается к поверхности клетки, создаются участки для дальнейшей агрегации; (3) группы тропоэластина высвобождаются, происходит сшивка и сборка на микрофибриллах; (4) тропоэластин включается в растущие эластичные волокна.
Большая часть образования эластина у млекопи‑ тающих происходит в позднем эмбриональном и раннем неонатальном периодах, а в зрелом воз‑ расте производство нового эластина прекращает‑ ся. В случае травмы синтез тропоэластина может быть быстро возобновлен. Сборка эластических волокон происходит только во время развития ткани, поэтому более старые сухожилия содержат меньше эластина, чем молодые. Фактически это оз‑ начает, что с возрастом жесткость, например, кожи увеличивается за счет деградации и фрагментации эластических волокон.
Период полураспада эластина составляет около 70 лет, по этой причине ранее эластин рассматри‑ вался как инертный белок, образующийся в процессе роста и сохраняющийся почти всю жизнь [10]. Подсчитано, что только около 1% пептидов эластина обновляется за десятилетие. Однако с те‑ чением времени (т. е. во время старения) эластин деградирует [11]; из‑за крайне низкого времени обновления разрушение эластина является прак‑ тически необратимым явлением. Это происходит из‑за связанной со старением повышенной актив‑ ности протеаз в богатых эластином тканях, что приводит к деградации эластина и, одновременно, к повышению отложения кальция (кальциноз). Рас‑ пад эластина приводит к получению пептидов, из‑ вестных как эластокины. Они биологически актив‑ ны и могут быть как физиологически полезны, так и участвовать в патологических процессах.
Эластокины играют пагубную роль на различных уровнях развития заболеваний. Они — продукты многих патологий, но также и участники пороч‑ ного круга прогрессирования болезней. Инъек‑ ции эластокинов мышам индуцируют типичные атеросклеротические поражения даже в отсут‑ ствие гиперхолестеринемии, то есть сами по себе посредством индукции воспаления, стимуляции иммунных клеток и аутоиммунного процесса спо‑ собны создавать благоприятную среду для атеро‑ склероза.
Продукты распада эластина также являются хе‑ мотаксическими для раковых клеток и участвуют в их выживании. Выяснено, что метастазирование происходит в ткани, богатые эластином. Сейчас этот эффект исследуют для применения в качестве биомаркера, отражающего тяжесть заболевания, такого как, к примеру, хроническая обструктивная болезнь легких или системная склеродермия [12].
После проведения ряда экспериментов было вы‑ яснено, что эластокины предотвращают и регу‑ лируют фотостарение кожи [13] за счет снижения активности эластазы, ингибирования апоптоза фибробластов и увеличения содержания гидрок‑ сипролина и воды. В то же время эластокины сти‑ мулируют пролиферацию фибробластов. Этот эффект используется в косметике для регенерации стареющей кожи.
В фармокологии эластиноподобные пептиды в со‑ ставе препаратов обеспечивают определенные те‑ рапевтические преимущества [14], такие как срав‑ нительно лучшая персистентность, стабильность, растворимость, биодоступность, период полурас‑ пада и/или биологическое действие терапевти‑ ческого компонента. Терапевтические средства, содержащие эластиноподобные пептиды, могут вводиться в меньших дозах и/или реже, чем их ана‑ логи.
На сегодняшний день исследуют множество эла‑ стиноподобных структур [2, 15], как природного, так и синтетического происхождения (табл. 1). Нерастворимый эластин получают путем химической очистки эластичных тканей животных от микрофи‑ бриллярных компонентов [16]; такой эластин при‑ меняют в качестве материала имплантатов, скаф‑ фолдов и систем восстановления мягких тканей. Нерастворимый эластин может подвергаться ги‑ дролизу для получения растворимых эластиновых препаратов. Фармакологические исследования, выполненные ранее на гидролизованном κ-эласти‑ не, показали его дермоструктурную активность и положительное влияние на стимулирование био‑ синтеза эластина в эпидермисе кожи человека [17]. Гидролизаты обладают способностью стимулиро‑ вать рост волос, улучшать сцепление с кожей голо‑ вы, защищать от вредных факторов окружающей среды [18], удерживать влагу в коже [19]. Следует, однако, понимать, что недостаточно очищенные продукты распада природного эластина могут вы‑ зывать аллергические реакции [20 – 22]. Во избежа‑ ние негативных эффектов натуральных продуктов, разрабатываются их синтетические аналоги.
ТАБЛ. 1. Эластин для биоинженерии и косметологии.
| КАТЕГОРИЯ | ПОЛУЧЕНИЕ |
МОЛЕКУЛЯРНАЯ МАССА, СШИВКА, ОСОБЕННОСТИ СТРУКТУРЫ |
ПРИМЕНЕНИЕ |
| Натурального происхождения | |||
| Децеллюляризованная ткань | химически | очень высокая; межмолекулярно сшитый; содержит другие компоненты внеклет. матрикса | протезирование мочевого пузыря, пищевода, клапанов сердца |
| Нерастворимый эластин | очень высокая; межмолекулярно сшитый | компонент каркаса скаффолдов* | |
| Тропоэластин | ~72 КДа | платформа для получения систем регенерации мягких тканей | |
| Гидролизованный эластин тип α | солюбилизацией щавелевой кислотой | гетерогенная смесь, в среднем 60 КДа | косметика для кожи и волос |
| Гидролизованный эластин тип β | гетерогенная смесь, в среднем 3-10 КДа | ||
| Гидролизованный эластин тип κ | солюбилизацией КОН | гетерогенная смесь, в среднем 70 КДа | |
| Гидролизованный эластин тип PSP | солюбилизацией пепсином | гетерогенная смесь, в среднем 25 КДа | |
| Гидролизованный эластин тип ASP | солюбилизацией кислотами | гетерогенная смесь, в среднем 25 КДа | |
| Гидролизованный эластин тип ESP | солюбилизацией эластазой | гетерогенная смесь | |
| Натурального происхождения | |||
| Тропоэластин | рекомбинацией | ~72 КДа | платформа для получения систем регенерации мягких тканей |
| Фрагменты тропоэластина | ~3-30 КДа в зависимости от номера экзона и повторов экзона | покрытие синтетических материалов, основа для сшивки в биоматериалы | |
| Эластиноподобные полипептиды | хим. синтезом / рекомбинацией | В зависимости от длины блока и повторений | восстановление мягких тканей |
| Эластин-фибронектин | рекомбинацией | синтетические трансплантанты | |
| Шелк-эластин | носители лекарств | ||
| Эластин-синтетический полимер [23] | хим. синтезом / рекомбинацией | скаффолды, гидрогели или биопокрытия | |
* Скаффолдами (ОТ АНГЛ. SCAFFOLD, «СТРОИТЕЛЬНЫЕ ЛЕСА») принято называть трехмерные подложки-носители для пространственного формирования будущей ткани или органа.
Литература
- Frantz C.,. Stewart K. M, Weaver V. M. The extracellular matrix at a glance // Journal of Cell Science. — 2010. — V. 123 (24). — p. 4195 – 4200.
- Daamen W. F. [et al.] Elastin as a biomaterial for tissue engineering // Biomaterials. — 2007. — V. 28 (30). — p. 4378 – 4398.
- Mecham R. P. Methods in elastic tissue biology: Elastin isolation and purification // Methods. — 2008. — V. 45 (1). — p. 32 – 41.
- Wang R. [et al.] Hierarchical assembly of elastin materials // Current Opinion in Chemical Engineering. — 2019. — V. 24. — p. 54 – 60.
- Karsdal M. A. Biochemistry of Collagens, Laminins and Elastin: Structure, Function and Biomarkers. Second edition. — Academic press for Elsevier Science, 2019. — 434 p.
- Wise S. G., Weiss A. S. Tropoelastin // The International Journal of Biochemistry & Cell Biology. — 2009. — V. 41 (3). — p. 494 – 497.
- Patent US20190153068A1 / 23.05.19
- Halper J., Kjaer M. Basic components of connective tissues and extracellular matrix: elastin, fibrillin, fibulins, fibrinogen, fibronectin, laminin, tenascins and thrombospondins // Progress in Heritable Soft Connective Tissue Diseases. Advances in Experimental Medicine and Biology — 2014. — V. 802. — p. 31 – 47.
- Hedtke T. [et al.] A comprehensive map of human elastin cross‐linking during elastogenesis // The FEBS journal. — 2019. — 25 p.
- Le Page A. [et al.] The role of elastin-derived peptides in human physiology and diseases // Matrix Biology. — 2019. — 33 p.
- Sherratt M. J., Tissue elasticity and the ageing elastic fibre // AGE. — 2009. — V. 31 (4). — p. 305 – 325.
- Гонтарь И. П., Емельянова О. И., Русанова О. А., Емельянов Н. И. Нарушение иммунопатогене‑ за основных типов коллагена и системы эла‑ стин-эластаза при системной склеродермии // Актуальные проблемы современной ревмато‑ логии. — 2018. — Т. 35. — с. 82 – 88
- Weihermann A. C. [et al.] Elastin structure and its involvement in skin photoageing // International Journal of Cosmetic Science. — 2017. — V. 39 (3). — p. 241 – 247.
- 4. Patent US20190091297A1 / 28.03.2019.
- Bax D. V. [et al.] Cellular response to collagen-elastin composite materials // Acta Biomaterialia. — 2019. — V. 86. — p. 158 – 170.
- Daamen W. F. [et al.] Comparison of five procedures for the purification of insoluble elastin // Biomaterials. — 2001. — V. 22 (14). — p. 1997 – 2005.
- Langmaier F. [et al.] Isolation of elastin and collagen polypeptides from long cattle tendons as raw material for the cosmetic industry // International Journal of Cosmetic Science. — 2002. — V. 24 (5). — p. 273 – 279.
- Zięba M. Application properties of shampoos containing hydrolyzed elastin and hydrolyzed keratin // Current trends in commodity science. Cosmetic Products Development. — 2017. — p. 151 – 162.
- Inou A. [et al.] Investigation of water-soluble elastin as a multifunctional cosmetic material: Moisturizing and whitening effects // Journal of cosmetic science. — 2017. — V. 68 (1). — p. 11 – 24.
- Patent US6451326B2 / 17.09.2002.
- Patent US8461113B2 / 11.06.2013.
- Verhulst L., A. Goossens. Cosmetic components causing contact urticaria: a review and update // Contact Dermatitis. — 2016. — V. 75 (6). — p. 333 – 344.
- Селянин М. А. [и др.] Полисахариды в медицине будущего — М.: «МАГИСТР-ПРЕСС». — 2015. — 254



 Сайт может содержать материалы, предназначенные для лиц старше 18 лет
Сайт может содержать материалы, предназначенные для лиц старше 18 лет
