Горизонтальная динамическая деформация как нетривиальное осложнение при коррекции десневой улыбки с помощью нейропротеина
Гань Чен (Gang Chen), Отделение пластической и реконструктивной хирургии, 9-я народная больница Шанхая, КНР
Карло Оранжес (Carlo M Oranges), Отделение пластической, реконструктивной, эстетической хирургии и хирургии кисти руки, больница университета Базеля, Швейцария
Сальваторе Джордано (Salvatore Giordano), Отделение пластической и общей хирургии, больница университета Турку, Финляндия
Вэнцзин Вань (Wenjin Wang), Отделение пластической и реконструктивной хирургии, 9-я народная больница Шанхая, КНР
Авторы анализируют анатомические особенности и патогенетические механизмы, вызвавшие необычное осложнение после инъекций нейропротеина типа А в целях коррекции десневой улыбки совместно с уменьшением величины крыльев носа у молодой женщины.
В последнее десятилетие существенно возрос интерес к этнической косметологии, и появились разнообразные способы коррекции тех или иных анатомических зон с учетом этноспецифических особенностей. Соответственно, процедуры омоложения лица с помощью инъекционных препаратов как никогда актуальны для косметологов.
В процедуру коррекции нижней трети лица у женщин часто входят инъекции в жевательную мышцу, гипертрофия которой может привести к слишком выступающему углу нижней челюсти и квадратной форме лица. Помимо этого распространенного запроса, пациентки все чаще обращаются за коррекцией динамических морщин и десневой улыбки. Десневую улыбку успешно устраняют путем инъекции нейропротеина типа А в мышцу, поднимающую верхнюю губу и крыло носа, и в мышцу, поднимающую верхнюю губу. Это безопасно и редко вызывает осложнения.
Аналогичным способом исправляют и излишнюю ширину основания крыльев носа. Этот дефект зачастую связан с формированием десневой улыбки, становится заметнее, когда человек улыбается или смеется. Редукцию основания крыльев носа можно успешно выполнить посредством манипуляций для коррекции десневой улыбки. Для достижения гарантированного желаемого результата следует обездвижить вышеуказанные мышцы. Но в описываемом случае было обнаружено осложнение в виде горизонтальной линии депрессии, появляющейся при улыбке и усугубляющейся при смехе. Ни о чем подобном ранее не упоминалось в статьях, посвященных коррекции десневой улыбки и синкинезий с помощью инъекций нейропротеина А. Самые распространенные побочные эффекты в этом случае — асимметрия улыбки, недостаточная подвижность рта и боль.
Описание случая
В клинику обратилась 28-летняя женщина с жалобами на десневую улыбку в сочетании с излишней шириной основания крыльев носа. Этот дефект становился хорошо заметен при улыбке, что вызывало у пациентки стеснение и социальный дискомфорт (рис. 1. А, Б).
Лечение проводилось в соответствии с протоколом коррекции десневой улыбки и уменьшения крыльев носа, включающим инъекцию нейропротеина А в мышцу, поднимающую верхнюю губу и крыло носа, и в мышцу, поднимающую верхнюю губу, по одной точке в каждой мышце, по 2,5 ЕД в каждую точку.
Через неделю десневая улыбка исчезла, а крылья носа визуально уменьшились, как и ожидалось. Однако обнаружилось и необычное осложнение. Во время улыбки у пациентки появлялась горизонтальная борозда (рис. 1. В-Г). Исчезла она спустя 3 месяца, когда перестал действовать ботулинический нейропротеин типа А (БНП).

РИС. 1 Фото до лечения: 28-летняя пациентка азиатского происхождения с жалобами на десневую улыбку и излишнюю ширину основания крыльев носа: А — в покое, Б — при улыбке. Фото через один месяц после инъекции нейропротеина А в мышцу, поднимающую верхнюю губу и крыло носа, и в мышцу, поднимающую верхнюю губу: В — при улыбке появляется горизонтальная вдавленная линия; Г-Д — при смехе она становится еще более выраженной. В динамике также заметно, что верхняя губа теперь поднимается на меньшую высоту.
Обсуждение
Возможное объяснение данного явления — физиологическая динамика процесса улыбки, задействующая мышцу, поднимающую верхнюю губу и крылья носа, мышцу, поднимающую верхнюю губу, большую и малую скуловые мышцы и мышцу смеха. Все эти мышцы сдвигают верхнюю губу в разных направлениях: поднимающая верхнюю губу и крылья носа и поднимающая верхнюю губу — вверх, а большая и малая скуловые — вверх и в сторону. Мышца смеха же растягивает рот в латеральном направлении.
губы. При этом мышцы, поднимающие верхнюю губу и крылья носа, уже не могли поднимать губу вверх, из-за чего в этой области при улыбке образовался избыток тканей. Таким образом, было выдвинуто предположение, что именно эта разница в толщине тканей верхней и нижней половин верхней губы привела к формированию горизонтальной линии депрессии при улыбке или смехе пациентки.
Заключение
При коррекции ширины основания крыльев носа и десневой улыбки, а также устранении синкинезий с помощью нейропротеина А следует быть особенно осторожными. Вследствие неравномерного баланса работы мышц, поднимающих губу, возможно появление горизонтальной линии депрессии.
Нейропротеин типа А: оценка быстроты появления эффекта и удовлетворенности пациентов
Э. Алуф (Alouf E), Т. Мерфи (Murphy T), Магистрантка по специальности «Семейная медсестра», школа медсестринского дела и валеологии колледжа Симмонс, США
Г. Алуф (Alouf G), Хирург-косметолог, медицинский руководитель компании Alouf Aesthetics, г. Сейлем, США
В свете постоянно растущего интереса к неинвазивным косметологическим процедурам, исследование было призвано определить, как быстро начинает действовать нейропротеин типа А на первичных (не проходивших ранее процедуру инъекций нейропротеина) и вторичных (проходивших ранее процедуру инъекций нейропротеина) пациентов, а также, как он влияет на степень их удовлетворенности процедурами. Данное простое слепое исследование проводилось на 15-ти взрослых испытуемых, которым были назначены процедуры коррекции нежелательных межбровных морщин с помощью нейропротеина.
До процедуры участники прошли опрос теста FACE-Q, предназначенного для определения удовлетворения результатами коррекции. Пациенты и исследователи оценили состояние межбровных морщин до лечения по пятибалльной шкале Merz. Далее пациенты каждый день делали фотографии обработанной области и отправляли их исследователям. Фотографирование выполнялось со дня проведения процедуры и до того дня, когда, по мнению и пациента, и исследователя, лечение начинало действовать. Под началом действия подразумевалось, что субъективно со стороны как пациента, так и исследователя, состояние соответствующей зоны улучшалось, по крайней мере, на 1 балл по пятибалльной шкале Merz. После того как было определено, что препарат начал действовать, участники заполняли вторую часть опросника FACE-Q.
В среднем эффект от процедуры наступал через 2,3 дня. Средний срок наступления эффекта составил 1,8 дня в группе первичных и 2,65 дня в группе вторичных пациентов. По результатам лечения пациенты сообщили о том, что выраженность межбровных морщин в среднем сократилась на 47,65%. В группе первичных пациентов сокращение составило 35,65%, а в группе вторичных — 59,67%.
В среднем до лечения пациенты заявили, что кажутся себе на 2,07 лет моложе реального возраста, а после лечения — на 6,47 лет. В среднем оказалось, что люди ощущали себя на 4,4 года моложе, чем до лечения. Обе группы пациентов выразили высокую удовлетворенность своим решением подвергнуться процедуре (в среднем 85,73%) и самим результатом (в среднем 86,20%). Ожидаемые баллы по FACE-Q после процедуры в среднем превысили ожидаемые баллы до операции на 8,25%; в неподготовленной группе эти баллы оказались превышены на 25,54%.
Скорость наступления эффекта у первичных и вторичных пациентов оказалась разной. Первичные ощутили эффект в среднем на 1 день быстрее, чем вторичные. На степень удовлетворенности влияет то, как быстро пациенту удалось заметить ощутимую разницу. Чем лучше они воспринимают свою внешность и чем моложе кажутся сами себе, тем выше их довольство результатом. Согласно результатам исследования, степень удовлетворенности определяется не только быстротой появления эффекта, но и улучшением внешнего вида и визуальным омоложением. Ключевым фактором является также отношение пациента, повлиять на которое можно, заранее поставив четкие цели, наладив эффективную коммуникацию и приглашая пациента на повторные консультации с целью оценки результатов.
Источник: Alouf Erin, Murphy Tina, Alouf Gregory. Botulinum Toxin Type A: Evaluation of Onset and Satisfaction. Plast Surg Nurs. 2019 Oct/ Dec;39(4):148-156. doi: 10.1097/ PSN.0000000000000287.
Ботулинотерапия области яремной вырезки при лечении некупируемых головных болей после операции в латеральной части основания черепа
С. Данг (Dang S), Медицинская школа при Университете Вандербилта, г. Нэшвилл, штат Теннесси, США
Дж. Р. Шинн (Shinn JR), Отделение отоларингологиихирургии головы и шеи, Медицинский центр Университета Вандербилта, г. Нэшвилл, штат Теннесси, США
Дж. Саудер (Sowder J), У. Р. Рис (Ries WR), С. Дж. Стефан (Stephan SJ), Отделение отоларингологиихирургии головы и шеи, Медицинский центр Университета Вандербилта, г. Нэшвилл, штат Теннесси, США. Отделение пластической и восстановительной хирургии лица, Медицинский центр Университета Вандербилта, г. Нэшвилл, штат Теннесси, США
Тяжело купируемые головные боли после операций в латеральной части основания черепа отмечаются у 23 – 75% пациентов и существенно снижают качество жизни. В настоящее время этиология таких болей не выяснена, и возможности лечения ограничены. Нейропротеин типа А используется по многочисленным функциональным и косметологическим показаниям, в том числе и от хронической мигрени. В литературе также упоминается его эффективность при купировании различных послеоперационных болевых синдромов. Целью авторов было описать ботулинотерапию как новый способ лечения некупируемых головных болей после операций в латеральной части основания черепа.
Методы
В рамках исследования четырем пациентам были сделаны подкожные инъекции нейропротеина в непосредственной близости к яремной вырезке для лечения некупируемых головных болей и болевых синдромов в области головы. Трое из этих пациентов ранее прошли операцию на латеральной части основания черепа, а у четвертого был взят фасциальный лоскут из височно-теменной области. Средняя дозировка инъекции составила от 20 до 60 единиц, средняя продолжительность эффекта — от 2-х недель до 4-х месяцев.
Результаты
Все пациенты отметили существенное ослабление хронической головной боли и вернулись за повторными периинцизионными инъекциями нейропротеина, что говорит об осознании пациентами пользы данной процедуры.
Выводы
Терапия нейропротеином может считаться новым методом лечения некупируемых головных болей после операций в латеральной части основания черепа и взятия фасциального лоскута из височно-теменной области. В данном исследовании описана небольшая выборка случаев, и хотя 100% пациентов отметили существенное улучшение, для подтверждения этих результатов потребуются дополнительные исследования.
Источник: Dang S, Shinn JR, Sowder J, Ries WR, Stephan SJ. Peri-Incisional Botulinum Toxin Therapy for Treatment of Intractable Head Pain After Lateral Skull Base Surgery: A Case Series. Headache. 2019 Oct;59(9):1624-1630.
Нейропротеин типа А улучшает приживаемость надмышечных жировых трансплантатов за счет усиления ангиогенеза и адипогенеза
М. Ву (Wu M)1 , Й. Ли (Li Y), Вань (Wang Z), Дж. Фень (Feng J), Дж. Вань (Wang J), С. Сяо (Xiao X), Ф. Лю (Lu F), Донь (Dong Z), Департамент пластической хирургии и косметологии при госпитале Нанфань, Южный медицинский университет, г. Гуанчжоу, КНР
Пересадка аутологичной жировой ткани часто используется для аугментации мягких тканей и реконструкции в пластической хирургии. Однако долгосрочную приживаемость трансплантатов сложно предсказать, особенно в случае жировых трансплантатов, связанных с мышечными структурами.
Целью исследования было определить, способен ли ботулинический нейропротеин типа А повысить приживаемость надмышечных жировых трансплантатов за счет ограничения подвижности мышц, а, следовательно, — усиления процессов ангиогенеза и адипогенеза.
Материалы и методы
Подопытные мыши были поделены на три группы:
Группа подготовки нейропротеином: подопытные мыши получили инъекцию БНП в правую четырехглавую мышцу бедра, а через неделю подверглись процедуре надмышечной пересадки жировой ткани.
Группа одновременной инъекции нейропротеина с пересадкой: подопытные мыши одновременно получили инъекцию БНП и подверглись трансплантации жировой ткани.
Контрольной группе мышей делали только трансплантацию, без инъекции БНП.
Были определены объемы трансплантатов, их подвергли гистологическому анализу и иммуноокрашиванию. Мыши, получившие одновременную инъекцию БНП и пересадку, дополнительно также подверглись двигательному анализу с помощью системы CatWalk XT.
Результаты
В группах с подготовительной инъекцией и одновременной инъекцией с пересадкой был отмечен существенно более высокий уровень приживаемости, а также скорость ангиогенеза и адипогенеза, чем в контрольной группе.
Вывод
Инъекции ботулинического нейропротеина улучшают показатель долговременной приживаемости надмышечных жировых трансплантатов, ограничивая подвижность мышц — вероятно, за счет усиления ангиогенеза и адипогенеза.
Источник: , Wu M, Li Y, Wang Z, Feng J, Wang J, Xiao X, Lu F, Dong Z. Botulinum Toxin A Improves Supramuscular Fat Graft Retention by Enhancing Angiogenesis and Adipogenesis. Dermatol Surg. 2019 Aug 12.
Ботулинотерапия синдрома Рейно
Сяолун Чжан (Xiaolong Zhang), Йонг Ху (Yong Hu), Заю Ни (Zhiyu Nie), Йе Сонг (Ye Song), Югуй Пэн (Yougui Pan), и др.
Весьма распространенный среди населения синдром Рейно заключается в эпизодическом спазме периферических артерий. Методы, которыми лечат синдром Рейно сейчас, не вполне эффективны, имеют побочные эффекты и зачастую подразумевают назначение избыточного количества лекарств. Есть данные о применении для лечения синдрома Рейно местных инъекций нейропротеина А, но во всех имеющихся исследованиях места инъекций, концентрация и дозировка БНП различаются. Кроме того, до сих пор не появлялось материалов об использовании местных инъекций БНП у больных синдромом Рейно азиатского происхождения. В настоящем ретроспективном исследовании приняли участие десять пациентов из Китая с синдромом Рейно. Все они страдали неустранимыми болями, не поддававшимися консервативному и (или) лекарственному лечению. Под контролем методов ультрасонографии пациентам с синдромом Рейно по определенной схеме делали инъекции БНП. Концентрация БНП составляла 20 ЕД/мл, в восстановлении без консервантов.
В каждую ладонь вводили по 50 ЕД ботулинического нейропротеина вокруг сосудисто-нервных пучков на уровне пястно-фалангового сустава. По 4 ЕД вводили в проекции локтевой и радиальной артерий, по 2 ЕД в начало общей ладонной пальцевой артерии, в начальной части и вокруг собственных ладонных пальцевых артерий. Инъекции проводились шприцами 1 мл с иглой 30G.
Результаты
Результаты оценивали методами ультрасонографии, контроля поверхностной температуры в области терапии, по визуальной аналоговой шкале (VAS) клинических симптомов (боль, онемение, ригидность, отечность), а также по изменениям характера проявления язв или гангрены.
В целом после местных инъекций БНП отмечалось значительное улучшение скорости артериального кровотока (P < 0,01), поверхностной температуры (P < 0,01), состояния язв и показателей клинических симптомов по VAS (рис. 2). Осложнения наблюдались крайне редко, жалоб на слабость кистей рук или кровоподтеки не поступало.
Вывод
Инъекции ботулинического нейропротеина по определенной схеме под контролем методами ультрасонографии могут стать полезным средством борьбы с не поддающимся коррекции синдромом Рейно.
Источник: Xiaolong Zhang, Yong Hu, Zhiyu Nie, Ye Song, Yougui Pan, Ying Liu, Lingjing Jin. Treatment of Raynaud’s phenomenon with botulinum toxin type A. Neurological Sciences volume 36, pages1225–1231(2015)
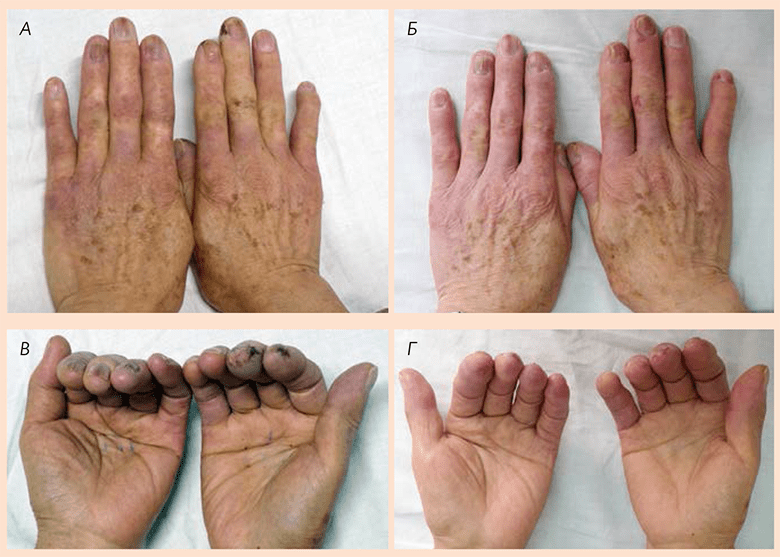
РИС. 2 Руки 91-летнего пациента с язвами, вызванными синдромом Рейно, до (А, В) и после инъекций БНП (Б, Г).
Психологический профиль лиц, обращающихся за минимально инвазивными косметологическими процедурами

Э. Озкюр (Özkur E), А. Киванч (Kıvanç Altunay İ), Ч. Айдын (Aydın Ç), Отделение психодерматологии, Университет здравоохранения, Учебно-исследовательский госпиталь Шишли-Этфаль, г. Стамбул, Турция
В последние годы очень многие люди стремятся изменить внешность в целях повышения социального статуса и психологического состояния. Спрос на минимально инвазивные косметологические процедуры продолжает расти. Исследователи изучили психологический профиль лиц, обращающихся за косметологическими процедурами. Перекрестное исследование в реальном времени проводилось с участием 54-х пациентов, обратившихся за косметологическими процедурами (инъекции нейропротеина, филлеров, мезотерапия, процедуры с использованием PRP и дермароллеров). Этих пациентов сравнивали с контрольной группой, которой ранее не проводились никакие косметологические процедуры (в том числе операции) и участники которой не выказывали такого желания.
Методы
Добровольцам, принимавшим участие в исследовании, был предложен биографический опросник (напр., возраст, пол, перенесенные ранее процедуры), а также шкалы оценки психологических функций, а именно: Brief Symptom Inventory (BSI), Automatic Thoughts Scale (ATS) и Social Adaptation Self-Evaluation Scale (SASS).
Результаты
За минимально инвазивными косметологическими процедурами обращаются преимущественно женщины (n = 46,85%), со средним образованием и выше, с высокими баллами по General Severity Index (P = 0,013), тревожностью (P = 0,018), депрессией (P = 0,004), межличностной эмпатией (P = 0,008) по BSI, а также высокими баллами по ATS (P = 0,022) и низкими по SASS (P = 0,001), означающими низкую социальную адаптацию. Была обнаружена статистически положительная корреляция между возрастом и GSI (General Severity Index — Индекс общей тревожности), тревожностью, депрессией, межличностной эмпатией, общим уровнем симптомов по BSI, а также отрицательная корреляция между баллами по SASS (Social Adaptation Self-Evaluation Scale — уровень социальной адаптации и самоидентификации) и возрастом, а также количеством перенесенных ранее процедур.
Источник: Özkur E, Kıvanç Altunay İ, Aydın Ç. Psychopathology among individuals seeking minimally invasive cosmetic procedures. J Cosmet Dermatol. 2019 Aug 14. doi: 10.1111/jocd.13101.

Инъекции нейропротеина в косметических целях выявляют бессимптомную миастению гравис
Грегори Тиммерманс (Grégory Timmermans), Фредерик Депьерре (Frédérique Depierreux), Изабель Хансен (Isabelle Hansen), Пьер Маке (Pierre Maquet), Отделение неврологии, Льежский университет, Университетский больничный центр Сар-Тиман, Льеж, Бельгия
Франсуа Ван (François Wang), Отделение нейрофизиологии, Льежский университет, Университетский больничный центр Сар-Тиман, Льеж, Бельгия
В данной статье речь пойдет о пациенте, у которого после косметической инъекции нейропротеина развились серьезные побочные реакции системного характера. Описанный случай демонстрирует риск, связанный с инъекциями нейропротеина у пациентов с субклиническими нарушениями процесса нервно-мышечной передачи, и предполагает необходимость проверки на миастению гравис в случае чрезмерно выраженного эффекта.
Локальные инъекции нейропротеина типа А часто выполняют в терапевтических или косметических целях, и, как правило, они безопасны. Возможные осложнения преимущественно связаны с местной или системной диффузией препаратов. Локальная диффузия нейропротеина в соседние мышцы — ситуация весьма распространенная и, как правило, проходящая. Например, после инъекции нейропротеина при дистонии шейных мышц нередко встречается дисфагия, а после инъекций в область глаз — птоз век. Возможна и системная диффузия БНП, но обычно она обходится без клинических последствий. Одноволоконные электромиографические исследования показали изменения в характере нервно-мышечной передачи в мышцах, удаленных от места инъекции, без каких-либо сопутствующих симптомов.
Тем не менее, в редких случаях системная диффузия приводит к возникновению клинических проявлений разной степени выраженности (дисфагия, генерализованная мышечная слабость, нарушения дыхания и т. д.). Такое состояние, известное как ятрогенный ботулизм, у здоровых в целом людей все еще встречается очень редко и обычно связано (по крайней мере, при косметологических процедурах) с выполнением недопустимых инъекций несертифицированных нейропротеинов в салонах красоты.
Если же у пациента имеется сопутствующее нервно-мышечное заболевание, такое как миастения гравис (МГ), опасность развития таких явлений после инъекции ботулинического нейропротеина повышается — даже при использовании малых доз. Такую повышенную восприимчивость можно объяснить синергетическим влиянием БНП и миастении гравис на нервно-мышечную блокаду. Предлагаемый вашему вниманию случай — один из менее чем десятка зарегистрированных по всему миру, когда миастения гравис была обнаружена после инъекции ботулинического нейропротеина. Но именно данный пациент впервые прошел подробное обследование методом одноволоконной электромиографии.
Описание случая
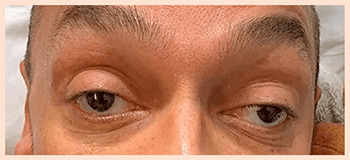
РИС. 1 43-летний мужчина с непроходящим двусторонним птозом век и постепенно усугубляющейся в течение 10 дней внешней офтальмоплегией.
43-летний мужчина с неотягощенным анамнезом, не получающий медикаментозного лечения какого-либо хронического заболевания, был направлен в отделение неотложной помощи в связи с двусторонним птозом век и бинокулярной диплопией, постепенно усугублявшимися на протяжении 10 дней (рис. 4). Изначально симптомы были выражены слабо, но за несколько
дней дело дошло до почти полного закрытия глаз и внешней офтальмоплегии. За шесть недель до появления этих симптомов пациенту была сделана инъекция abobotulinumtoxin A с косметологической целью в область межбровных, лобных и морщин латерального угла глаза (84 ЕД суммарно за одну процедуру)
Аналогичную инъекцию пациенту делали двумя годами раньше, без каких-либо нежелательных эффектов. Неврологический осмотр, за исключением симптомов со стороны глаз, не выявил никаких нарушений. Результаты анализов крови и спинномозговой жидкости, а также данные МРТ мозга также были в норме. Первое электронейромиографическое исследование (ЭНМГ) показало нормальные результаты — скорость и латентность нервной проводимости (малоберцовые и икроножные нервы), а также амплитуда электрических вызванных ответов мышц (ЭВОМ) оказались в пределах нормы, угасание реакции составило менее 10% при многократной стимуляции лицевых нервов (в области носовой мышцы и круговой мышцы глаза), правого локтевого нерва (мышца, отводящая мизинец), а также лучевого нерва (локтевая мышца), частотой 3 Гц.
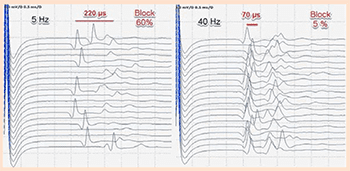
РИС. 5 Результаты одноволоконной ЭМГ круговой мышцы левого глаза, демонстрирующие усиленное колебание с блокировкой импульсов. В большинстве нервно-мышечных синапсов среднее значение колебания и процент блокировки уменьшаются с повышением частоты пульсации, что предположительно указывает на предсинаптические нарушения.
Однако одноволоконная электромиограмма круговой мышцы левого глаза показала наличие серьезного нарушения нервно-мышечной передачи (колебания в среднем на 112 микросекунд с 50% блокировкой). Любопытно, что в большинстве нервно-мышечных синапсов потенциал действия и блокировка были выше при низких частотах импульса (5 Гц), чем при высоких (40 Гц), что наводит на мысль о наличии предсинаптического расстройства (рис. 5).
Исходя из этих клинических и электрофизиологических данных, было сделано предположение о локальном воздействии ботулинического нейропротеина. Прежде всего, пациент получил пиридостигмин 240 мг/день перорально, исходя из интуитивного предположения, что это улучшит нервно-мышечную передачу. Однако никакого эффекта это не возымело. Подкожные же инъекции неостигмина по 0,25 мг каждые 2 часа принесли быстрое, но в целом умеренно выраженное клиническое улучшение. Тем не менее, это лечение пришлось прекратить спустя несколько дней из-за сильной брадикардии.
Через две недели состояние пациента снова ухудшилось: усилился птоз век, дисфагия и субъективная общая слабость. На этот раз многократный анализ стимуляции нервного волокна на частоте 3 Гц показала угасание реакции во всех протестированных мышцах (угасание в процентах от площади: правая мышца носа 35%, левая мышца носа 36%, правая трапециевидная 26%, правая локтевая 24%, правая отводящая мизинец 29%). Правая отводящая мизинец мышца продемонстрировала восстановление сниженного ответа (6 против 29%) через 1 минуту после произвольного сокращения, после чего этот показатель снова ухудшился (37 против 29%) через 3 минуты после данной попытки, что предполагает наличие постсинаптического нарушения.
В рамках гипотезы о миастении был измерен уровень антител к ацетилхолиновым рецепторам в плазме крови. Результат оказался положительным на уровне 6,4 нмоль/л (нормальные значения < 0,5), что было подтверждено повторным анализом. Таким образом, был поставлен параллельный диагноз «миастения гравис»
Лечение пиридостигмином постепенно возобновили (существенной брадикардии больше не возникло) в сочетании с метилпреднизолоном 1 мг/кг перорально. После этого было отмечено медленно прогрессирующее клиническое улучшение. Дисфагия и общая слабость полностью исчезли за 4 недели, а умеренный птоз и офтальмопарез сохранялись в течение более чем 6 месяцев.
Дискуссия
Случай этого пациента — восьмой из описанных в литературе случаев латентного течения миастении, выявленного по результатам инъекции ботулинического нейропротеина, при этом наиболее подробно описанный с точки зрения электрофизиологии. Информация о предыдущих случаях представлена в (табл. 1). Следует отметить, что инъекция нейропротеина делалась тогда пациентам с уже выставленным диагнозом «миастения».
Ботулинический нейропротеин замедляет пресинаптический выброс ацетилхолина в нейромышечном синапсе, тогда как антитела миастения гравис блокируют ацетилхолиновые рецепторы на постсинаптической стороне. Таким образом, в сочетании эти два механизма обеспечивают синергетическое действие на нервно-мышечную передачу. Возможно, этим явлением объясняются клинические проявления, наблюдавшиеся у пациента. В данном конкретном случае тот факт, что симптомы были наглядны и отличались стабильностью (отсутствие колебаний симптоматики) и были связаны исключительно с периорбитальной областью, а также наличие в недавнем анамнезе инъекции ботулинического нейропротеина в область глаз можно считать весомым аргументом в пользу локального действия нейропротеина.
| Первый автор, год [№ публ.] | Показания (возраст, пол) | Мышцы, получившие инъекцию | Доза БНП (тип) | Предыдущие инъекции БНП | Симптомы (скрытый период/продолжительность) | Результаты ЭМГ |
| Brunnschweiler, 1997 | Терапевтические: дистония шейных мышц (56, Ж) | Ременная мышца головы | 12,5 ЕД (Dysport) | Не указано | Дисфагия, слабость жевательных мышц, одышка (3 нед./ не указано) | Ослабление (% не указан) в левой дельтовидной и левой «лицевой» |
| Borodic, 1998, далее Tarsy, 2000 | Терапевтические: блефароспазм, оромандибулярная дистония, дискинезия (80, Ж) | Круговая мышца глаза, нижняя часть лица | 120 ЕД (Botox) | 18 инъекций (30 – 120 ЕД) за предыдущие 13 лет, без осложнений | Птоз, диплопия, дизартрия, дисфагия, общая слабость (4 дня/5 мес.) | Нормальная многокр. стимуляция ↑ дрожание в обл. задних мышц шеи и верхних конечностей |
| Iwase,2006 | Терапевтические: блефароспазм (78, Ж) | Круговая мышца глаза | 40 ЕД (не указано) | 2 инъекции ( 80 ЕД и 60 ЕД) 1 мес. и 4 мес. ранее, без осложнений | Дисфагия, дизартрия, общая слабость (1 нед./3 мес.) | Не указано |
| Dressler, 2010 | Терапевтические: дистония шейных мышц (66, Ж) | Грудино-ключично-сосцевидная м., ременная м. головы, трапециевидная м. | 72 ЕД (Botox) | 6 серий инъекций (72 – 180 ЕД), время не указано | Диплопия (1 мес./ не указано) | Не указано (патологическая серийная стимуляция) |
| Glick,2013 | Косметические: межбровные морщины и латеральные морщины в углах глаз (64, Ж) | Окологлазные мышцы | 58 ЕД (не указано) | 1 инъекция 8 мес. раньше (25 ЕД), без осложнений | Диплопия (1 нед./ не указано) | Не указано |
| Durmuş-Tekçe,2016 | Терапевтические: оромандибулярная дистония (80, Ж) | Подъязычноязычная м. | 10 мыш. ЕД (не указано) | 8 инъекций (10 ЕД) каждые 3 месяца до описываемого случая, без осложнений | Птоз, диплопия, дисфагия, одышка, общая слабость (10 дней/ 6 мес.) | Многокр. стимуляция: дисфункция нервно-мышечных синапсов |
| Chegini,2017 | Косметические: лицевые морщины (30, Ж) | Не указано | Не указано | 2 инъекции в предшествующие месяцы, без осложнений | Птоз, диплопия, дисфагия, дизартрия, одышка, общая слабость (предшествующие месяцы/ не указано) | Многокр. стимуляция: признаки пред- и парасинаптической миопатии |
| Timmermans(настоящаястатья) | Косметические: морщины в межбровье и в латеральных уголках глаз (43, M) | Окологлазные мышцы | 84 ЕД (Azzalure) | 1 инъекция двумя годами раньше, без осложнений | Птоз, диплопия, дисфагия, общая слабость (6 нед./ более 6 мес.) | ↑ дрожание (круговая м. глаза), ослабление |
Однако последующее клиническое ухудшение, проявляющееся дисфагией и общей слабостью, уже невозможно объяснить одним лишь локальным действием нейропротеина: оно наводит на мысли о существовании системного процесса, связанного с самим по себе токсином (ятрогенный ботулизм), либо нервно-мышечного расстройства, либо и того, и другого. Учитывая присутствие антител к ацетилхолиновым рецепторам, частичную реакцию на неостигмин и весьма характерную электрофизиологическую картину, в итоге исследователи пришли к диагнозу «миастения гравис».
Возможно, миастения ранее носила латентный характер, а инъекция приблизила ее к диагностическому порогу за счет своего обычного субклинического воздействия на нервно-мышечные синапсы как близлежащих, так и далеко расположенных мышц. Иначе говоря, нервно-мышечная передача, уже поврежденная с постсинаптической стороны за счет субклинического действия антител к ацетилхолиновым рецепторам, окончательно дала сбой, когда и предсинаптический компонент оказался под действием нейропротеина.
У пациента период между инъекцией нейропротеина и появлением клинических симптомов оказался необычно долгим (порядка 6 недель), при том, что в других описанных случаях латентный период длился от 1 до 36 дней. Причина такой отсроченности неизвестна. Еще один интересный момент заключается в том, что раньше, два года назад, серия инъекций не вызвала никаких побочных эффектов. Такая ситуация наблюдалась в других случаях ятрогенного ботулизма (с миастенией гравис или без нее): осложнения возникали только после нескольких серий инъекций. Объяснение может заключаться в том, что характер распространения нейропротеина в организме непредсказуем и от инъекции к инъекции существенно различается. Наконец, следует подчеркнуть, что данный пациент страдал от сильно выраженных осложнений, несмотря на применение обычных доз ботулинического нейропротеина. Аналогичные результаты отмечались и в ранее описанных случаях: симптомы могли спровоцировать даже такие низкие дозы, как 12 ЕД. Это подчеркивает повышенную восприимчивость лиц с нарушениями нервно-мышечной передачи к действию нейропротеина. Однако стоит отметить, что другим пациентам с миастенией гравис удавалось успешно проводить терапию нейропротеином А без всяких осложнений.
Электрофизиологическое исследование позволяет отследить симптомы и пред-, и постсинаптического характера. Классическая электромиографическая картина при миастении гравис следующая: угасающая реакция электрических вызванных ответов мышц на многократную низкочастотную стимуляцию, ослабление угасания сразу через 1 минуту после произвольных физических упражнений, а затем усиление угасания через 3 – 4 минуты после упражнений (постактивационное истощение).
У пациента многократная стимуляция показала типичные признаки миастении гравис, но не ботулизма. В целом можно сказать, что зафиксированные электрофизиологические отклонения сочетают в себе признаки пред- и постсинаптической дисфункции нервно-мышечной передачи.
Заключение
Синергетический эффект миастении гравис и ботулинического нейропротеина объясняет, почему пациенты, страдающие субклиническими заболеваниями нервно-мышечной передачи, подвержены повышенному риску нежелательных явлений после инъекций БНП. Если известно, что у пациента имеется подобное заболевание, или присутствуют очевидные клинические признаки (например, дисфагия), рекомендуется действовать с большой осторожностью и либо отказаться от инъекций, либо, если другого варианта нет, применять нейропротеин в минимальных дозировках.
При этом эффективного способа выявить пациента с латентными, субклиническими нарушениями в нервно-мышечных синапсах до инъекции ботулинического нейропротеина не существует. Значит, перед инъекциями необходимо собрать полный анамнез и провести физикальный осмотр, выделяя любые клинические данные, потенциально указывающие на латентную миастению гравис. Если у пациента усиленная реакция на ботулинический нейропротеин, особенно если он реагирует на ингибиторы ацетилхолинэстеразы, необходимо оценить вероятность наличия миастении гравис, прежде чем продолжать инъекции. И наконец, даже если в прошлом подобные инъекции уже проводились и это не вызвало проблем, это не гарантирует отсутствия осложнений в дальнейшем, даже если планируется вводить малые дозы нейропротеина.
Источник: Статья печатается с сокращениями. Полный текст и ссылки на литературу вы найдете здесь: Grégory Timmermans, Frédérique Depierreux, François Wang, Isabelle Hansen and Pierre Maqueta. Cosmetic Injection of Botulinum Toxin Unmasking Subclinical Myasthenia Gravis: A Case Report and Literature Review. Case Rep Neurol. 2019 May-Aug; 11(2): 244–251.



 Сайт может содержать материалы, предназначенные для лиц старше 18 лет
Сайт может содержать материалы, предназначенные для лиц старше 18 лет
